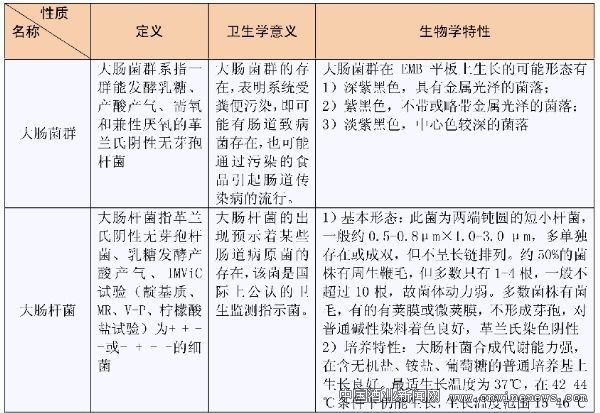
大腸菌群指那些能發酵乳糖、產酸產氣、需氧和兼性厭氧的革蘭氏陰性無芽孢桿菌。大腸菌群的存在表明系統已經受到糞便污染,并可能有腸道致病菌存在,因此可能通過污染的食品引起腸道傳染病的流行。對于食品行業來講,做好大腸菌群的檢測和防御工作,至關重要。本文根據作者的經驗,談談啤酒生產過程中大腸菌群的檢測及控制。
1. 大腸菌群與大腸桿菌的比較
大腸菌群與大腸桿菌的定義范圍不同,其體現的特性也有差別,主要區別見表1所示。
2. 大腸菌群的檢測綜述
目前食品行業測定大腸菌群的方法有國標法(GB)、行標法(SN)和快速檢測法(3M)。三種方法各有特點,其中,國家標準采用三步法:1)乳糖發酵試驗:樣品稀釋后,選擇三個稀釋度,每個稀釋度接種三管乳糖膽鹽發酵管。36±1℃培養48±2h,觀察是否產氣。2)分離培養:將產氣發酵管培養物轉種于伊紅美藍瓊脂平板上,36±1℃培養18h—24h,觀察菌落形態。3)證實試驗:挑取平板上的可疑菌落,進行革蘭氏染色觀察。同時接種乳糖發酵管36±1℃培養24±2h,觀察產氣情況。報告:根據證實為大腸桿菌陽性的管數,查MPN表,報告每100ml(g)大腸菌群的MPN值;行標法采用兩步法:1)推測試驗:樣品稀釋后,選擇三個稀釋度,每個稀釋度接種三管LST肉湯。36±1℃培養48±2h,觀察是否產氣。2)證實試驗:將產氣管培養物接種煌綠乳糖膽鹽(BGLB)肉湯管中,36±1℃培養48±2h,觀察是否產氣。以BGLB產氣為陽性。查MPN表,報告每ml(g)樣品中大腸菌群的MPN值。兩種方法的比較結果見表2所示。
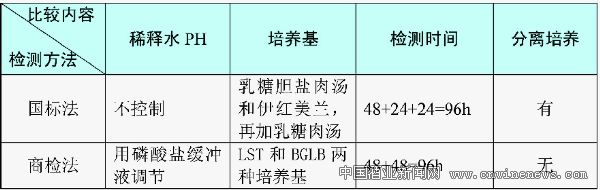
因為采取的檢測方法、過程和試劑的差異,利用國標法(GB)和商檢法(SN)檢測啤酒中的大腸菌群時,得出的結論也很難絕對一致,通常商檢法(SN)的檢測結果比國標法(GB)的檢測結果稍高一些,這可能是國標法比商檢法對雜菌控制更為嚴格的緣故。另外采用3M快速檢測法檢測大腸菌群時使用的是固體培養基直接計數,而GB和SN的檢測都是經過液體培養基增菌的。原理不一樣,結果也會有偏差,使用時應該以國標為基準進行合理校正,以增加檢測結果的可信任度和可比性。
3. 檢測過程中的注意事項
3.1 取樣時的注意事項
無菌取樣時,應注意如下幾點:
1)取樣時,要針對取樣容器的結構、材質和理化性質,選擇酒精擦拭、火焰燃燒等適當的滅菌方式進行取樣口表面滅菌,其中在使用滅菌時,應當注意滅菌的起始位置和運動方向,防止因冷凝水沉積,而影響檢測結果。
2)在對容器或管道進行液體無菌取樣時,要充分排除和主題基質不一致的前端樣品,排除量一般為端口體積的2—3倍為宜,以確實保證取樣的代表性,排出的樣品要用導管導入排污口或者進行回收,以減少損失,避免污染。
3) 取樣時應盡快取樣,盡快處理,防止樣品受到二次污染或者因為環境條件的變化引起樣品中微生物的生長、繁殖和死亡,造成不應有的檢測誤差。
4)取樣時最好使用專門的取樣器配合取樣,以避免產生二次污染,尤其對于那些結構復雜的取樣口容器,應盡量避免取樣口表面、內容物或者空氣對樣品造成污染,使檢測結果造成假陽性。
5) 取樣完畢,要用清水輕輕沖洗取樣口內外表面,確保沒有積水或者酒液殘存時,用75%的酒精進行擦拭滅菌,最后用拖把將地面擦洗干凈,工具按規定放到固定的地方。
3.2 發酵試驗時的注意事項
檢驗的第一步是做發酵試驗,以觀察產酸和產氣現象。做發酵試驗時,應注意如下幾點:
1)乳糖發酵管做法是大試管中裝一支倒立的小管,然后加入乳糖發酵液9ml—10ml,以超過小試管1cm—2cm為宜。然后滅菌,滅菌后防止小試管中產生氣泡,避免檢測結果出現假陽性。
2) 觀察產氣時,主要看小導管里面是否有氣泡,有時為了把握,也可以在培養的次日,搖動試管仔細觀看發酵液和管壁有無小氣泡上浮,有其中之一者就可以判斷有產氣現象發生。
3) 大腸桿菌是產酸產氣的,但是產氣是中間產物,而產酸是最終產物,所以說產氣不一定就有大腸桿菌,而產酸就可能有大腸桿菌。
4) 為了判斷大腸菌群的存在,有時可以通過觀察產氣量或者基質顏色的變化幅度,來定性判斷樣品是否含有大腸菌群,對于檢測來說是一個捷徑,但實際上把握性不大,還需要進一步的分離培養。
3.3 分離培養時的注意事項
對于產酸和產氣的培養液,還要進行分離培養,以通過觀察菌落顏色和形態,來判斷樣品中有無大腸菌群。分離培養時,應注意以下幾點:
1) 結晶紫中性紅膽鹽瓊脂,是大腸菌群固體培養基測定法時用到的,正常應在使用前臨時配制,放置時間最好不要超過3小時。
2)結晶紫中性紅膽鹽瓊脂在配制時,要保證充分的煮沸和攪拌,一般應煮沸2分鐘以上,以使培養基成份完全溶解,直至沒有泡沫為止,最后將其溫度冷卻到45℃—50℃時使用。
3) 按9管法測定大腸菌群時,要按實際產酸產氣的數量進行一一轉接,也就是說,如果9支發酵管全部產氣,那么要接種9個伊紅美蘭瓊平板。當然如果操作熟練的話,一個平板可以劃線接種兩支或更多的發酵管,但一定要標明稀釋度,作好標記,以防混淆。
4)在用接種環從產氣的發酵管轉種至伊紅美蘭瓊脂(EMB瓊脂)平板過程中,劃線要均勻一致,且要注意每轉種一次,接種環要進行徹底灼燒,以免交叉污染。
5)制取培養及時,要加入膽鹽、十二烷基硫酸鈉、洗衣粉、煌綠、龍膽紫、孔雀綠等抑菌劑,以抑制其它雜菌的活動,這樣有益于大腸菌群細菌的挑選,但抑菌劑同樣也會對大腸菌群中的某些菌株產生抑制作用。所以使用時要嚴格控制使用量,以免影響檢測結果。
3.4 證實試驗時的注意事項
首先觀察培養菌落的顏色和特征,然后挑取典型菌落進行革蘭氏染色進行證實試驗。做證實試驗時,應注意以下幾點:
1)挑取菌落數與大腸菌群的檢出率有密切關系,只挑取一個菌落,由于機率問題,尤其當菌落不典型時,很難避免假陰性的出現。所以挑菌落時一定要挑取典型菌落,如無典型菌落則應多挑幾個,以增加檢查的可靠性。
2)革蘭氏染色主要取決于細胞壁的結構,做大腸菌群的染色試驗時,應在培養后立即染色試驗,避免因時間過長造成假陰性。
3)因為在酸性培養液中生長的細胞,蛋白質為堿性,不宜與堿性染色液染成牢固的顏色,容易出現假陰性,操作時要注意快速準確,把握好監測的時間。
4) 在做樣品的涂片時,要注意厚薄均勻,不可過厚過密,以分散開為準,否則,使酒精在規定時間內脫色不易達到一致的結果,影響對試驗結果的判斷。
5) 在證實試驗中用到的試劑,應按照規定現配現用或配成濃溶液,臨用前稀釋,以免藥劑失效,影響檢測結果。
4. 防止污染的措施
大腸菌群往往通過所使用的原料、工藝過程、空氣、設備、工具等進入生產系統。為了防止污染,通常采用的措施有以下幾點:
4.1 加強啤酒生產用水的環境治理和前期消毒滅菌處理,杜絕大腸菌群污染源。定期對釀造用水進行檢測,發現問題,立即對癥解決。
4.2 冷麥汁設備在使用前先用85℃以上的熱水清洗滅菌,然后再用85℃1%—2%的火堿進行清潔無菌,冷卻檢測合格后投入使用。
4.3 發酵工段的地面經常打掃,杜絕粘滑。與生產無關或無用的物質及時清理出車間或定置擺放。 發酵工段的管排經常擦抹除塵,管排連接閥門保持潔凈,連接管禁止接地。
4.4 發酵罐使用完畢,先用清水噴淋10—15分鐘,無泡沫后,用堿性清洗劑清洗60分鐘,再用常溫水沖洗30分鐘,后用酸性清洗劑洗滌20分鐘,最后用雙氧水循環滅菌20分鐘。
4.5 酒泵、輸酒管路和膠管除按規定鏈接有關容器執行PIC清洗外,還要定期的做拉刷處理和甲醛浸泡處理。
4.6 對于發酵工段的管排連接件,要經常的進行人工刷洗或連接管路上進行管路CIP洗滌,不用時,放入特定的水槽內,用1%火堿溶液或殺菌劑(二氧化氯濃度大于200PPm,雙氧水濃度大于0.5%,常溫下浸泡,浸泡不少于2小時。使用前用無菌水沖凈或文章來源華夏酒報連接管路上進行管路CIP洗滌)。
4.7 過濾機用完后,先用清水沖洗至無泡沫為止,用時約10—15分鐘。用40℃—50℃以上熱堿水沖洗并排放,當熱堿水變清、雜質較少時開始循環,循環10—20分鐘為止。用CIP水沖洗 ,至PH呈中性,最后用殺菌液(雙氧水≥0.5%)浸泡。過濾紙板不用時,放置在干燥通風處,防止滋生雜菌。
4.8 灌酒機在使用前后先用冷水沖洗設備至無泡沫時,后用70℃熱水進行清洗滅菌,再用1%—2%的火堿進行清潔滅菌,完成后選擇有代表性的管酒閥進行微生物檢測,合格后方可使用。
4.9 對生啤酒進行巴士殺菌時,殺菌PU值應控制在15—20范圍以內,以確保生啤酒中的微生物被殺滅,保證成品酒的衛生指標合格。
總之,做好大腸菌群的檢測工作,及時反饋啤酒生產過程的衛生狀況,是改善和提高企業衛生管理水平的重要手段。為此企業要做好以下幾方面的工作:1)要充分認識做好大腸菌群檢測工作的必要性和重要性,要投入充足的物力、財力和人力,保證硬件設施完善高效。2)科學合理的制定大腸菌群的檢測規程,嚴格按照規程和規律,做好大腸菌群的檢測工作。3)選定啤酒生產過程的關鍵控制點,制定出完善的控制措施,定時檢測大腸菌群水平,保證100%的衛生合格率。4)制定科學合理的殺菌、清潔工藝和程序,完善保證措施,確保清潔殺菌過程有效地進行,做好生產過程的衛生管理工作。

