丙肝巨頭吉利德(Gilead)丙肝雞尾酒Harvoni近日在美國監(jiān)管方面再傳喜訊,F(xiàn)DA已批準(zhǔn)擴(kuò)大Harvoni(ledipasvir/sofosbuvir)的適用人群,用于伴有晚期肝臟疾病的丙肝患者。具體而言,F(xiàn)DA已批準(zhǔn)Harvoni聯(lián)合利巴韋林(RBV)的12周治療方案,用于:(1)無肝硬化或伴有代償性肝硬化(Child-Pugh A)的基因型1或基因型4慢性丙型肝炎病毒(HCV GT-1,HCV GT-4)感染的肝移植受者;(2)伴有失代償肝硬化(Child-Pugh B/C)的基因型1慢性丙型肝炎病毒(HCV GT-1)感染者,包括已開展肝移植術(shù)的患者。
這也使得Harvoni現(xiàn)在可用于更廣泛的患者群體,包括:基因型1、4、5、6丙肝患者,HCV/HIV-1共感染者,基因型1/4丙肝肝移植受者,伴有失代償肝硬化的基因型1丙肝患者。
此次批準(zhǔn)對吉利德尤其重要,因?yàn)樵撆鷾?zhǔn)賦予了Harvoni相對競爭對手艾伯維丙肝雞尾酒Viekira Pak一個(gè)顯著的競爭優(yōu)勢。去年10月,在收到數(shù)例Viekira Pak治療伴有中重度肝硬化(Child-Pugh B & C)或肝纖維化丙肝患者導(dǎo)致肝功能衰竭及其他肝臟疾病的報(bào)告后,F(xiàn)DA發(fā)布安全性警告,Viekira Pak可能在伴有潛在肝臟疾病的群體中引發(fā)嚴(yán)重的肝損傷。該安全性警告觸發(fā)了Viekira Pak處方標(biāo)簽的變化,盡管這一變化僅適用于約5%的丙肝群體,但仍導(dǎo)致艾伯維Viekira Pak在2015年第四季度的銷售低于預(yù)期。
此次批準(zhǔn)也非常關(guān)鍵,因?yàn)樵撆鷾?zhǔn)擴(kuò)大了吉利德最暢銷藥物Harvoni的患者群體,盡管是一個(gè)相對較小的比例,當(dāng)仍足以實(shí)現(xiàn)額外的不菲收入。據(jù)估計(jì),全球范圍內(nèi)有多達(dá)1.5億丙肝患者,美國有320萬例。根據(jù)美國疾病控制和預(yù)防中心(CDC)數(shù)據(jù),高達(dá)20%的丙肝患者將發(fā)展為肝硬化。
在美國、歐洲和日本,丙肝所致肝硬化是肝移植的首要適應(yīng)癥。至少70%丙肝患者在肝移植3年內(nèi)出現(xiàn)慢性肝臟疾病,大約20-30%丙肝患者會(huì)在肝移植5年內(nèi)出現(xiàn)肝硬化。相較而言,在非肝移植患者群體中,丙肝感染至少20年時(shí)間才會(huì)出現(xiàn)肝硬化。另外,根據(jù)CDC數(shù)據(jù),在美國有超過120萬HIV感染者,大約30%合并感染HCV。
當(dāng)前,Harvoni和Sovaldi的銷售額占到了吉利德總銷售額的60%以上,這也使得吉利德在未來的盈利將嚴(yán)重依賴這2種藥物。根據(jù)吉利德的數(shù)據(jù),Harvoni在2015年的全球銷售額為138.6億美元,吉利德預(yù)計(jì)今年的銷售將持平,該公司將面臨一個(gè)正在飽和的丙肝市場。此外,12周方案94500美元的高昂價(jià)格,也嚴(yán)重限制了Harvoni進(jìn)入美國大多數(shù)州的健康計(jì)劃。
另一方面,默沙東開發(fā)的丙肝雞尾酒Zepatier近日也獲得了FDA批準(zhǔn),售價(jià)較Harvoni低42%以上,這將再一次不可避免地在美國丙肝市場掀起一場激烈的價(jià)格戰(zhàn)。業(yè)界預(yù)計(jì),到2017年,Zepatier的市場份額將達(dá)到11%,將帶來22億美元的銷售。
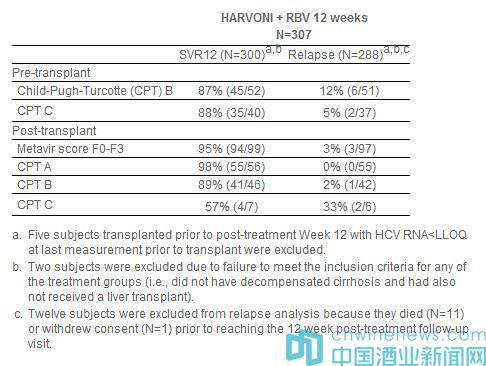
此次批準(zhǔn),是基于2個(gè)開放標(biāo)簽II期臨床研究(SOLAR-1,SOLAR-2)的積極頂線數(shù)據(jù)。該研究在已接受肝移植術(shù)或伴有失代償肝硬化的初治(treatment-naive)和經(jīng)治(treatment-experienced)基因型1和基因型4丙肝患者中開展,評估了Harvoni聯(lián)合利巴韋林(RBV)12周方案和24周方案的療效和安全性。SOLAR-1和SOLAR-2研究中基因型1丙肝患者的匯總數(shù)據(jù)如下表所示:
 ?
?
在無肝硬化或伴有代償性肝硬化的基因型4丙肝肝移植后患者組(n=12)中的SVR12數(shù)據(jù)與基因型1丙肝的SVR12數(shù)據(jù)相似,無患者復(fù)發(fā)。伴有失代償肝硬化(肝移植前和肝移植后)的基因型丙肝患者組中的數(shù)據(jù)不充分,不足以推薦劑量。SOLAR-1和SOLAR-2研究中12周方案治療組共計(jì)7例患者伴有纖維化於膽性肝炎(FCH),這些患者均實(shí)現(xiàn)了SVR12。FCH是一種罕見、嚴(yán)重的復(fù)發(fā)型肝炎類型,之前尚無藥物獲批治療FCH。

